作为一种潜在的、可替代动物模型的前沿技术,3D细胞体外模型(包括但不限于类器官)近年来受到行业内广泛的关注,包括肠、肝、胃、胰腺、脑、心脏等一系列类器官模型被成功建立,用于研究生物发育、疾病机制及药物研发等领域中。
常见的类器官包括成体干细胞(ASCs)和多能干细胞(PSCs)两种系统。其中PSC系统遗传背景清晰、明确的分化方向及、更广泛的适应性及基因工程更易结合等优势,但周期长、过程复杂、投入大等问题。
相对地,ASCs系统则来源于具有一定再生能力的类器官(尤其上皮类器官),常用于构建正常/癌性类器官,具有周期短、易获取、具有天然肿瘤微环境(TME)等优点。本文将围绕ASC系统构建类器官的工程学方法进行简单的总结。
常规的ASC系统一般基于matrigel包埋后加入特殊培基进行体外培养,目前这些过程主要依赖于有经验的研发人员手工操作。行业上游的设备供应商对上述环节也做了各种各样的尝试,以期望提高自动化程度,提高实验批次间可靠性、稳定性。

图1 基于ECM包埋法构建类器官模型
◆ 基于Nanowell技术
构建均一性细胞球
利用工程学手段构建数百微米的nanowell,配合特殊的超低吸附表面修饰或水凝胶材料,使得细胞悬液沉底后形成3D细胞球。
诸如Corning、Sartorius等厂家均提供类似产品(图2),其显著优势是成球通量显著上升、信噪比提高明显[1]。
最早这种方案主要用于细胞系成球培养(Spheroids),目前也有团队尝试用该方法构建类器官并进行悬浮培养(Matrigel<2%)[2]。
当然,由于构建的Nanowell尺寸小,其表面张力较大,细胞悬液(或培基)不容易渗入微孔中,所以一般厂家会推荐前处理方案,比如用表面活性剂对nanowell进行预处理,离心后移除表面活性剂,用培基润洗后重新加入细胞悬液等。
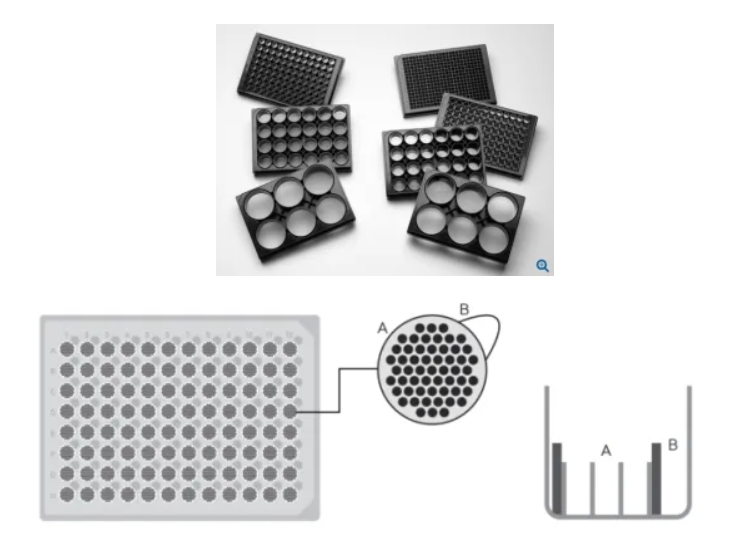
图2 各种商业化nanowell耗材
◆ 基于挤出式3D打印
构建均一性细胞球
由于经典的类器官培养本身是将细胞悬液与matrigel(细胞外基质材料)混合后用移液枪分配到孔板里,所以最早出现自动化设备其实也是基于类似原理的挤出式方案(图3)。

图3 商业化挤出式打印设备
作为较早出现的类器官自动化方案,挤出式打印在一定程度上完成了模型制备过程的标准化,这种传统的类器官构建方案在一定程度上帮忙研究者更好理解诸如肿瘤发生发展机制或者是药物杀伤机制等。
随着科学研究的进一步推进,这种传统的类器官模型的局限性也日益突出。以肿瘤类器官为例,由于传统构建方式仅仅保留了肿瘤细胞,而丧失了体内特有的微环境,导致体外研究观察的肿瘤发生发展与体内存在着显著差异,或者基于该传统模型构建的药物响应与临床效果不一致等情况,限制了类器官技术的应用。因而,能够在体外重建微环境的系统显得愈加重要。
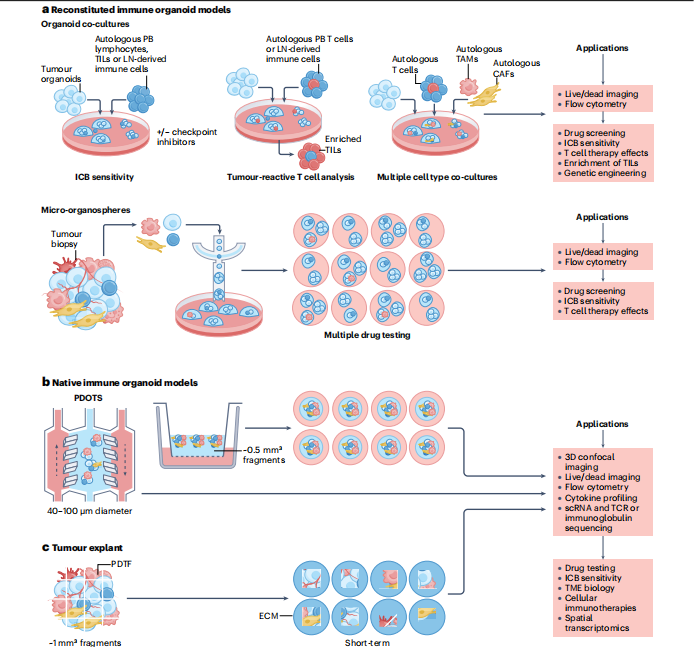
图4 几种体外重建类器官构建技术
◆ 基于微流控技术的
新型类器官解决方案
2024年8月,在Nature Review Cancer上刚刚发表了一篇重量级综述 “Cancer organoids 2.0: modelling the complexity of the tumour immune microenvironment” ,总结了几种新一代类器官模型构建方式,并就工程化体外重建免疫/肿瘤微环境对疾病建模、药物研发、精准医疗的重要性进行详细阐述[3]。
作者将构建体系分成两大类,一种是基于工程学重建免疫微环境体系的解决方案,另一种是保留天然免疫微环境解决方案,前者适合大规模、标准化建模、高通量药物筛选,后者由于前处理的不确定性以及样本用量等原因,更适合小规模机制性研究(图4)。
基于工程学方法重建具有免疫微环境体系的解决方案,行业内最著名的案例就是Xilis的MOS平台技术。
2021年7月8日,生物科技初创公司Xilis宣布完成一项 7000 万美元的A轮融资,用于进一步推进名为MicroOrganoSphere™(MOS)类器官技术平台,为癌症患者提供个体化的精准治疗策略,并加速药物发现和开发。
2022年,Xilis在《Cell Stem Cell》发表文章介绍该技术——基于液滴夹流构建类器官/3D细胞球微小反应体系,可在14天内对肿瘤病人来源的类器官完成构建-药物筛选-治疗方案建议的全流程(图5)。
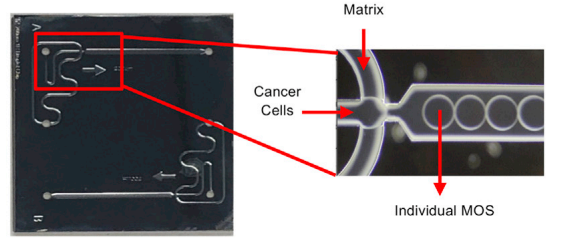
图5 基于液滴夹流技术开发新一代类器官构建技术
与前代技术相比,其典型优势是利用微流控技术将样本进行类似“数字化”处理,形成微系统进行高通量培养,可改善传统培养方案下不同细胞存在竞争抑制而导致评估偏倚,或缺乏免疫/肿瘤微环境对药物效应的偏差[4]。
◆ 傲睿科技专利技术
提供独特类器官解决方案
傲睿自主研发数字液滴技术是另一种新型微流控技术,具有微量上样、高精度细胞操控的优点,可形成高通量、标准化3D体外模型构建(图6)。
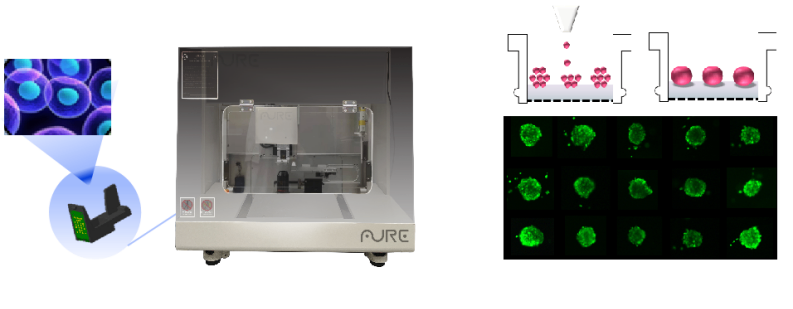
图6 傲睿数字化液滴打印平台BP4000系列
该系统支持体外免疫微环境重构,可将免疫细胞精确定位递送到3D肿瘤类器官上,并精确控制细胞数量,用于研究类器官对药物刺激效应,帮助研究者更快更高效找到表现优异的免疫药物候选对象。
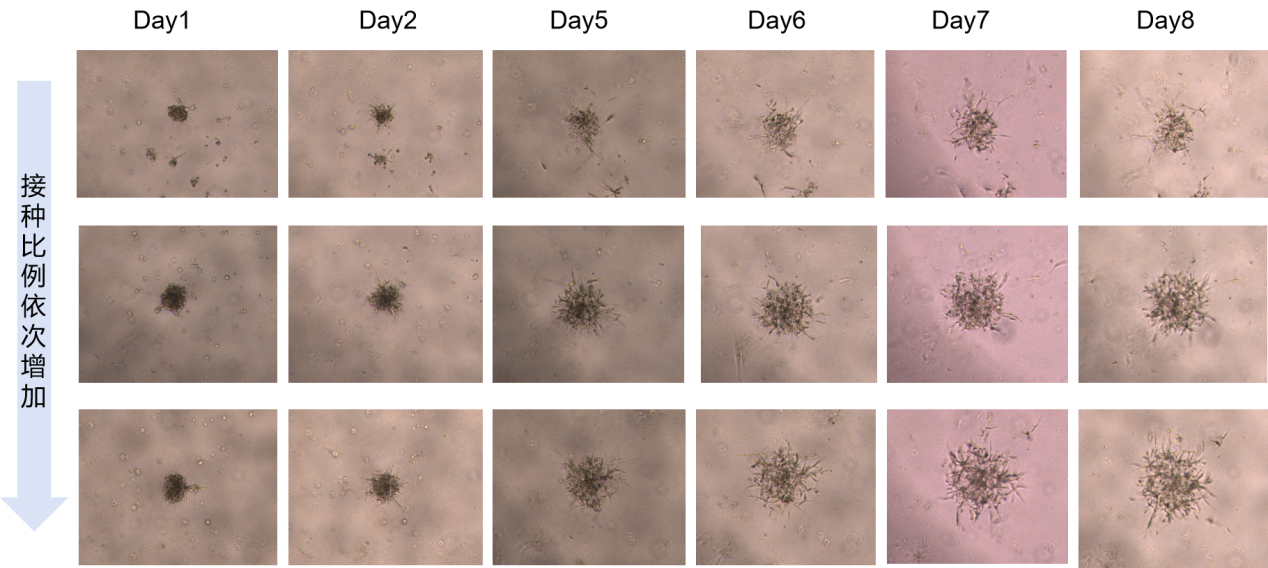
图7 基于BP4000平台构建人间皮瘤原代3D模型
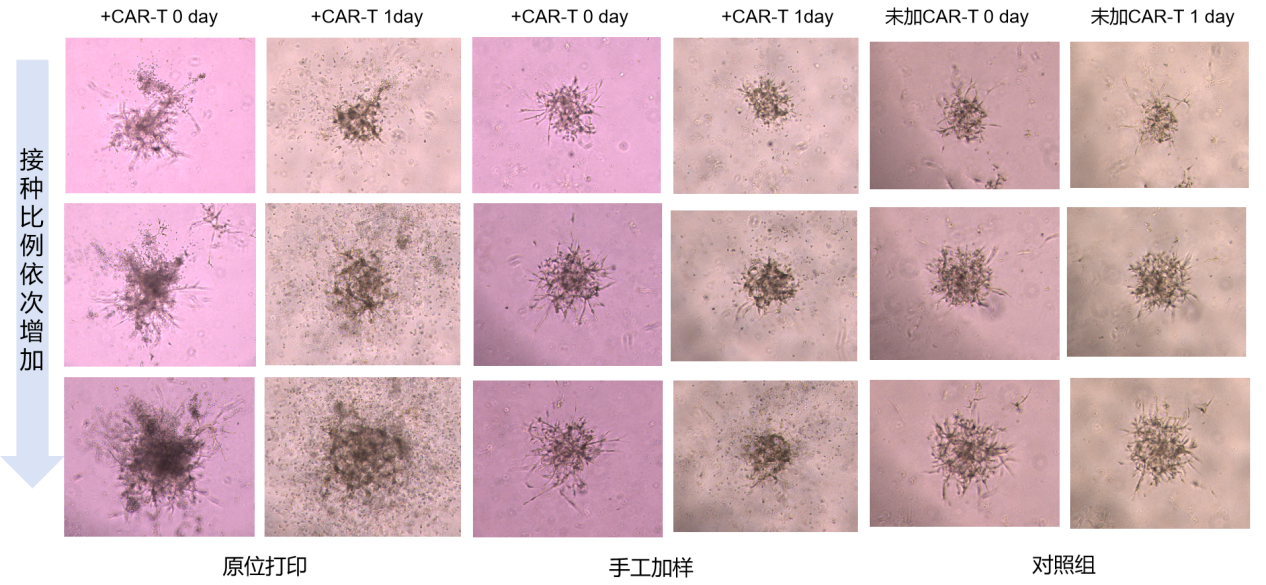
图8 利用BP4000高精度原位递送CAR-T药物至靶区
图7是傲睿科技与某CAR-T药物研发企业合作案例。通过BP4000系统,设定不同参数,可制备大小可控的、标准化、高通量的人间皮瘤原代3D模型,孔间一致性CV<10%。
经过6天培养,原位递送CAR-T细胞药物到肿瘤模型的靶区域,图6中红色箭头标记为CAR-T细胞。
原位打印组别和手工加样组别添加相同数量T细胞,原代打印可将CAR-T细胞精确定位到原代肿瘤球上,而手工添加CAR-T细胞则分散在整个孔里,因而靶区CAR-T细胞细胞几乎不可见,可以预见手工加样方式下真正参与杀伤的CAR-T细胞远低于实验预期。
经24小时加药刺激后,可以观察到原代打印测试组CAR-T增殖杀伤效果明显优于手工添加组别。
傲睿科技研发BP4000系列产品还可帮助研究者构建其他复杂模型,如不同类型细胞团互作、结合MIMICUp系统研究静态/动态免疫共培养、不同掺杂方式构建肿瘤微环境以及3D水平高通量药物筛选等(图9)。
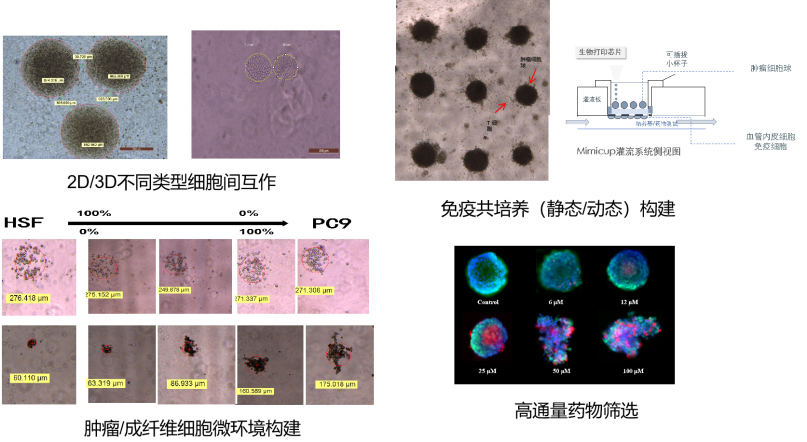
图9 BP4000系列产品辅助建模功能
引用文献
[1] Antoni D, Burckel H, Josset E, and Noel G. (2015). Three-dimensional cell culture: a breakthrough in vivo. International journal of molecular sciences, 16(3), 5517-5527. doi:10.3390/ijms16035517.
[2] Tan Tao, et al. Low-viscosity matrix suspension culture for human colorectal epithelial organoids and tumoroids. Bio-protocol 12.8 (2022): e4394-e4394.
[3] Cancer organoids 2.0: modelling the complexity of the tumour immune microenvironmentNature Review Cancer,Volume 24 | August 2024 | 523–539
[4] Ding et al., Patient-derived micro-organospheres enable clinical precision oncology,2022, Cell Stem Cell 29, 1–13.






